
专属客服号

微信订阅号
剖析产业发展现状
为区域/园区工作者洞悉行业发展
摘要:自2016年全面开始仿制药质量和疗效一致性评价工作开始以来,我国的仿制药企业就开启了一次长时间的一致性评价征程。2018年10月18日距离目标时间截止日期2018年底,时间仅剩余2个半月,一致性评价进展如何?目前出台哪些措施解决存在问题?以及出台政策后一致性评价会延期吗?本文会做出细致分析。

2016年3月,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》,意见要求289个基药目录品种,除需开展临床有效性试验和存在特殊情形外,应在2018年底前完成一致性评价,逾期未完成的,不予再注册。通过一致性评价途径大概有三种:第一种是常规流程:做相应的药学、BE试验等,提交申请,再获得通过一致性评价的补充批件;第二种是部分药品按新3、4注册申报,其注册要求中就包含与原研药质量相当,获批即视同通过一致性评价;第三种是一些药品已在欧美或日本上市,国内外共线生产,也可视同通过一致性评价。为了让一致性评价工作更好的落实,CFDA公告了相关目标计划、落实细则、也制订了一些列政策。
通过激励型和惩罚型政策推动一致性评价进度
激励型政策方面:对通过一致性评价的药品,在采购环节给予明显的政策支持,并鼓励优先使用一致性评价品种。国家医保局组织召开的药品集中采购试点座谈会上,明确落实通过一致性评价品种临床替换原研药,特别提出“讨论用各省70%的市场份额交换通过一致性评价产品以及原研产品的最低报价,并以产品的最低报价作为医保的支付价”,从医保和采购两方面支持仿制药一致性评价。“
惩罚型政策方面:通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。药品一致性评价走在最前列的江西省,在医药采购服务已作出领先相应调整,根据2018年8月份江西省医药采购服务平台发布“关于调整部分药品网上采购资格的通知”,来自四家药企的苯磺酸氨氯地平片,因没有通过仿制药一致性评价(此前已有其他三家企业通过一致性评价),被暂停网上采购资格。全国范围内至少17省份已落实仿制药一致性评价品种直接挂网政策。
一致性评价进度缓慢,2018年底完成目标计划或将延迟
(1)一致性评价进度缓慢。截至10月15日,仅有189个受理号属于“289目录”,完成进度仅为65.4%。药审中心承办的一致性评价申请受理号为438个,涉及品种178个,其中上个月份承办的受理号多达81个,为前9个月数量最多的月份,创评价工作开始以来历史新高(详见图1)。
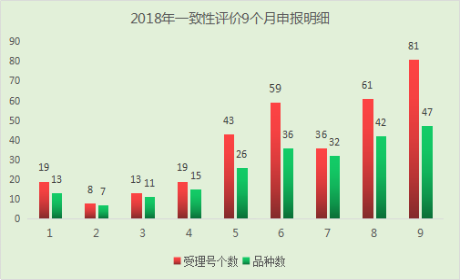
图1 2018年一致性评价前9个月申报明细
(数据来源:CDE、药智网数据库)
通过比对“289目录”一致性评价评审状况情况来看,一致性评价438个申请受理号中,仅有189个受理号属于“289目录”,涉及药品种类63个,通过(含视同通过)一致性评价的“289目录”品规数共有34个,涉及品种18个;不批准通过一致性评价的受理号有2个,涉及品种2个,不批准的理由是申报企业申请豁免人体生物等效性研究的依据不充分。
(2)一致性评价药企竞争激烈,尤其是在传统类药物领域。
截止2018年10月18日,根据通过一致性评价TOP前十品种来看:通过评审企业数最多的药品为瑞舒伐他汀钙片,申报企业7家、通过评审企业达4家;苯磺酸氨氯地平片、蒙脱石散、头孢呋辛酯片、厄贝沙坦片、富马酸替诺5类药物通过评审企业为3家;阿莫西林胶囊、盐酸二甲双胍片、卡托普利片、恩替卡韦分散片4类药物通过评审企业为2家(详见图2)。
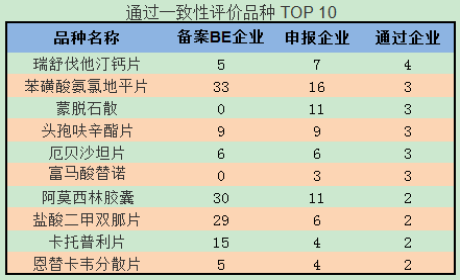
图 2通过一致性评价品种TOP10
(数据来源: CDE、药智数据库)
传统类药物竞争激烈:申报企业较多,通过率普遍低。苯磺酸氨氯地平片申报企业16通过评审企业仅3家,通过率为18.8%;蒙脱石散类药物申报企业11家,通过评审企业3家,通过率为27.3%;阿莫斯林胶囊申报企业11家,通过率为18.2%
通过以上数据比对可以看出,289个基药品种一致性评价工作推进缓慢,历时2年6个月,完成进度仅为65.4%,离目标时间仅有2.5个月时间,如何在极少时间内完成34.6%工作,成为国家食品药品监督管理总局亟需解决的问题。
药审中心直面一致性评价进度缓慢问题,并推出四项解决措施
2018年9月28日,针对当前企业在一致性评价申报工作中存在的问题,加大服务和指导企业做好药品一致性评价申报资料整理工作,做好2018年底前289基药品种一致性评价的阶段性工作,药审中心现就289基药品种的申报与技术问题沟通事项通知如下:
表1 一致性评价存在问题点及对策
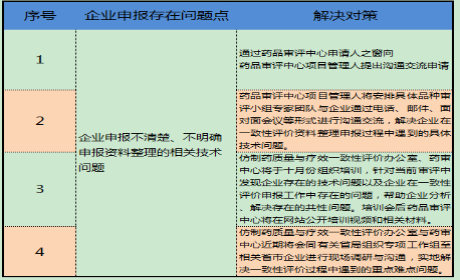
资料来源:CDE官网
仿制药一致性评价工作,对我国医药行业有十分重要的意义,推进仿制药在质量与药效上达到与原研药一致的水平。对已经批准上市的仿制药进行一致性评价,能提高仿制药药品质量、淘汰落后制药工艺技术,保证人民群众用药安全和有效性。
结语
推进仿制药在质量与药效上达到与原研药一致的水平,对我国医药行业有十分重要的意义,但目前落实一致性评价进度缓慢导致的原因:如企业重视程度不够、较高的药学与临床费、药学研发周期长和BE平台少、传统药制药工艺进步缓慢等诸多问题,没有在前期得到根本解决解决是一致性评价推进缓慢的重要原因。因此鉴于药品一致性评价进度缓慢、剩余时间不多,虽然药审中心出台临时对策,但笔者认为,一致性评价延期的概率仍然相当大。
本文为我公司原创,欢迎转载,转载请标明出处,违者必究!
请完善以下信息,我们的顾问会在1个工作日内与您联系,为您安排产品定制服务
评论